2×Taq Platinum PCR มิกซ์
คำจำกัดความของกิจกรรม
กิจกรรม 1 หน่วย (U) Taq Platinum DNA Polymerase ถูกกำหนดให้เป็นปริมาณของเอนไซม์ที่จำเป็นในการรวม 10 nmol deoxynucleotides ลงในสารที่ไม่ละลายในกรดที่อุณหภูมิ 74°C ภายใน 30 นาทีโดยใช้ DNA สเปิร์มของปลาแซลมอนที่กระตุ้นเป็นแม่แบบ/ไพรเมอร์
ควบคุมคุณภาพ
ความบริสุทธิ์โดยการตรวจจับ SDS-PAGE มากกว่า 99%; ไม่พบกิจกรรมของนิวคลีเอสจากภายนอก ยีนสำเนาเดียวในจีโนมมนุษย์สามารถขยายได้อย่างมีประสิทธิภาพ ไม่มีการเปลี่ยนแปลงกิจกรรมที่สำคัญเมื่อเก็บไว้ที่อุณหภูมิห้องเป็นเวลาหนึ่งสัปดาห์
พารามิเตอร์ทางเทคนิคหลัก
มีกิจกรรม exonuclease 5'-3' และกิจกรรม exonuclease 3'-5' และความถูกต้องอยู่ถัดจาก Pfu polymerase ความเร็วในการขยายของ Taq Platinum Polymerase นั้นเร็วกว่า Pfu polymerase และประสิทธิภาพการขยายเสียงก็สูงกว่า ผลิตภัณฑ์ PCR สามารถผูกติดกับปลายทู่หรือโคลนด้วยเวกเตอร์ TA ได้โดยตรง หากจำเป็นต้องปรับปรุงประสิทธิภาพการโคลน ขอแนะนำให้ทำให้บริสุทธิ์ก่อนและเพิ่มระยะยื่น 3'-dA ก่อนทำการโคลนลงในเวกเตอร์ TA
One-tube Taq Platinum MasterMix (การรับรองผลิตภัณฑ์ไฮเทคระดับประเทศ)
■ Taq Platinum MasterMix ได้ปรับปรุงความจำเพาะและความไวของปฏิกิริยา PCR และสามารถขยายเทมเพลตที่ซับซ้อนด้วยเนื้อหา GC สูง โครงสร้างรอง และอื่นๆ ที่คล้ายกัน สามารถขยายสำเนาเทมเพลตเป้าหมายได้เพียง 2 ชุด เพื่อให้ได้ผลการทดสอบที่แม่นยำยิ่งขึ้น
■ สูตรเฉพาะของ Taq Platinum MasterMix ทำให้ระบบปฏิกิริยาทั้งหมดมีความเสถียรมาก และกิจกรรมจะไม่ได้รับผลกระทบจากการแช่แข็ง-ละลายซ้ำหรือการจัดเก็บระยะยาวที่ 4°C
■ สารละลาย PCR แบบผสมที่เตรียมไว้ล่วงหน้าที่เสถียรและมีประสิทธิภาพสามารถทำให้การทำงานรวดเร็วและง่ายดาย ซึ่งช่วยลดความเข้มของแรงงานและข้อผิดพลาดในการสุ่มตัวอย่างได้อย่างมาก ตัวเพิ่มประสิทธิภาพ PCR ประสิทธิภาพสูงและตัวเพิ่มประสิทธิภาพจะรวมอยู่ในส่วนผสม ซึ่งช่วยลดข้อกำหนดในเงื่อนไข PCR
■ ผลิตภัณฑ์นี้มีทั้งระบบที่มีสีย้อมและปราศจากสีย้อม ผลิตภัณฑ์ MasterMix ที่ประกอบด้วยสีย้อมสามารถถูกอิเล็กโตรโฟเรสได้โดยตรงหลังจาก PCR โดยไม่ต้องเพิ่มบัฟเฟอร์การโหลด
แอปพลิเคชั่น
สามารถแทนที่ Pfu polymerase เพื่อขยายผลิตภัณฑ์ที่มีความเที่ยงตรงสูงจากเทมเพลตที่ซับซ้อน เช่น จีโนม และเหมาะสำหรับการใช้งานต่างๆ เช่น การโคลนยีนการแสดงออก การกลายพันธุ์เฉพาะจุด และการวิเคราะห์ single nucleotide polymorphism (SNP) เป็นต้น
ข้อควรระวังในการออกแบบไพรเมอร์ PCR:
ความยาวไพรเมอร์มักจะ 20-25 เมอร์ อย่างไรก็ตาม เมื่อดำเนินการ PCR แบบแยกส่วนแบบยาว ควรเพิ่มความยาวไพรเมอร์เป็น 30-35 เมอร์
■ ไม่มีการจับคู่เสริมระหว่างไพรเมอร์ทั้งสอง โดยเฉพาะ 3 เบสสุดท้ายที่ปลาย 3′
■ เนื้อหา GC ควรเป็น 50-60% และหลีกเลี่ยง GC หรือ AT ที่อุดมไปด้วยในท้องถิ่น ในการทำให้ไพรเมอร์และเทมเพลทมีความเสถียร ให้หลีกเลี่ยงโครงสร้าง AT Rich ที่ปลาย 3′
■ หลีกเลี่ยงไพรเมอร์เพื่อสร้างโครงสร้างรอง
■ เลือกไพรเมอร์สองตัวที่มีอุณหภูมิ Tm ใกล้กัน
การคำนวณค่า Tm ของไพรเมอร์สำหรับ PCR:
■ เมื่อไพรเมอร์น้อยกว่า 20 mer: Tm=2°C×(A+T)+4°C×(G+C)
■ เมื่อไพรเมอร์มากกว่า 20 เมอร์: Tm=81.5+0.41×(GC%)-600/L โดยที่ L คือความยาวของไพรเมอร์
■ ตั้งอุณหภูมิการหลอมที่ (Tm-5)°C
PCR ไพรเมอร์อินพุต
ความเข้มข้นสุดท้ายที่เหมาะสมของไพรเมอร์สามารถเลือกได้ระหว่าง 0.1 μM ถึง 1.0 μM ความเข้มข้นของไพรเมอร์ที่ต่ำเกินไปจะทำให้ได้ผลผลิตของผลิตภัณฑ์ที่มีการขยายเสียงต่ำ ในขณะที่ความเข้มข้นของไพรเมอร์ที่สูงเกินไปมีแนวโน้มที่จะมีการขยายสัญญาณที่ไม่เฉพาะเจาะจงมากกว่า โดยปกติ เมื่อปริมาณของเทมเพลต DNA มีขนาดใหญ่หรือเทมเพลต DNA ที่ซับซ้อน (เช่น DNA ของจีโนมมนุษย์) ถูกใช้เป็นเทมเพลต ความเข้มข้นของไพรเมอร์ควรลดลง เมื่อปริมาณของแม่แบบ DNA มีขนาดเล็กหรือใช้แม่แบบ DNA (เช่น plasmid DNA เป็นต้น) เป็นแม่แบบ ความเข้มข้นของไพรเมอร์ควรสูงขึ้น
ผลิตภัณฑ์ทั้งหมดสามารถปรับแต่งสำหรับ ODM/OEM สำหรับรายละเอียดกรุณาคลิกบริการที่กำหนดเอง (ODM/OEM)
 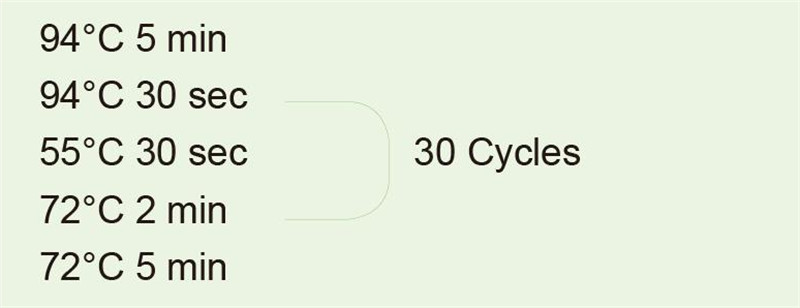 |
ใช้จีโนม DNA เป็นเทมเพลตเพื่อขยายแฟรกเมนต์ 1 kb หลังจากปฏิกิริยา PCR ให้ใช้ 5 ไมโครลิตรสำหรับการตรวจจับอิเล็กโตรโฟรีซิส |
เทมเพลต A-1
■ แม่แบบประกอบด้วยสิ่งเจือปนโปรตีนหรือสารยับยั้ง Taq เป็นต้น —— ทำให้แม่แบบ DNA บริสุทธิ์ ขจัดสิ่งเจือปนของโปรตีน หรือแยก DNA แม่แบบด้วยชุดการทำให้บริสุทธิ์
■ การเปลี่ยนสภาพของแม่แบบไม่สมบูรณ์ —— เพิ่มอุณหภูมิการเสื่อมสภาพอย่างเหมาะสมและยืดเวลาการเสื่อมสภาพให้นานขึ้น
■ การลดขนาดเทมเพลต —— เตรียมเทมเพลตอีกครั้ง
A-2 ไพรเมอร์
■ ไพรเมอร์คุณภาพต่ำ —— สังเคราะห์ไพรเมอร์อีกครั้ง
■ การเสื่อมสภาพของไพรเมอร์ —— แบ่งไพรเมอร์ที่มีความเข้มข้นสูงเป็นปริมาตรเล็กๆ เพื่อถนอมอาหาร หลีกเลี่ยงการแช่แข็งและละลายหลายครั้งหรือแช่เย็นที่อุณหภูมิ 4°C ในระยะยาว
■ การออกแบบไพรเมอร์ที่ไม่เหมาะสม (เช่น ความยาวไพรเมอร์ไม่เพียงพอ มีไดเมอร์เกิดขึ้นระหว่างไพรเมอร์ เป็นต้น) -ออกแบบไพรเมอร์ใหม่ (หลีกเลี่ยงการก่อตัวของไพรเมอร์ไดเมอร์และโครงสร้างรอง)
A-3 มก.2+ความเข้มข้น
■ มก2+ ความเข้มข้นต่ำเกินไป —— เพิ่ม Mg . อย่างเหมาะสม2+ ความเข้มข้น: ปรับ Mg . ให้เหมาะสม2+ ความเข้มข้นโดยชุดของปฏิกิริยาตั้งแต่ 1 mM ถึง 3 mM โดยมีช่วงเวลา 0.5 mM เพื่อกำหนด Mg ที่เหมาะสมที่สุด2+ ความเข้มข้นสำหรับแต่ละแม่แบบและไพรเมอร์
A-4 อุณหภูมิการหลอม
■ อุณหภูมิการหลอมที่สูงส่งผลต่อการยึดเกาะของสีรองพื้นและแม่แบบ —— ลดอุณหภูมิการหลอมและปรับสภาพให้เหมาะสมด้วยการไล่ระดับ 2°C
A-5 ขยายเวลา
■ ขยายเวลาสั้น——เพิ่มเวลาขยาย.
ปรากฏการณ์: ตัวอย่างเชิงลบยังแสดงแถบลำดับเป้าหมายด้วย
A-1 การปนเปื้อนของ PCR
■ การปนเปื้อนข้ามของลำดับเป้าหมายหรือผลิตภัณฑ์ที่มีการขยายเสียง —— ระวังอย่าปิเปตตัวอย่างที่มีลำดับเป้าหมายในตัวอย่างเชิงลบหรือหกออกจากหลอดสำหรับการหมุนเหวี่ยง น้ำยาหรืออุปกรณ์ควรผ่านการฆ่าเชื้อด้วยไอน้ำเพื่อกำจัดกรดนิวคลีอิกที่มีอยู่ และควรพิจารณาการมีอยู่ของการปนเปื้อนผ่านการทดลองควบคุมเชิงลบ
■ การปนเปื้อนรีเอเจนต์ —— แบ่งรีเอเจนต์และเก็บที่อุณหภูมิต่ำ
A-2 ไพรม์r
■ มก2+ ความเข้มข้นต่ำเกินไป —— เพิ่ม Mg . อย่างเหมาะสม2+ ความเข้มข้น: ปรับ Mg . ให้เหมาะสม2+ ความเข้มข้นโดยชุดของปฏิกิริยาตั้งแต่ 1 mM ถึง 3 mM โดยมีช่วงเวลา 0.5 mM เพื่อกำหนด Mg ที่เหมาะสมที่สุด2+ ความเข้มข้นสำหรับแต่ละแม่แบบและไพรเมอร์
■ การออกแบบไพรเมอร์ที่ไม่เหมาะสม และลำดับเป้าหมายมีความคล้ายคลึงกันกับลำดับที่ไม่ใช่เป้าหมาย ——ออกแบบไพรเมอร์ใหม่
ปรากฏการณ์: แถบขยายสัญญาณ PCR ไม่สอดคล้องกับขนาดที่คาดไว้ ไม่ว่าจะใหญ่หรือเล็ก หรือบางครั้งมีทั้งแถบขยายสัญญาณเฉพาะและแถบขยายสัญญาณที่ไม่เฉพาะเจาะจงเกิดขึ้น
เอ-1 ไพรเมอร์
■ความจำเพาะของไพรเมอร์แย่
——ออกแบบไพรเมอร์ใหม่
■ ความเข้มข้นของไพรเมอร์สูงเกินไป —— เพิ่มอุณหภูมิการทำให้เสียสภาพอย่างเหมาะสมและยืดเวลาการเสื่อมสภาพให้นานขึ้น
A-2 มก.2+ ความเข้มข้น
■ Mg2+ ความเข้มข้นสูงเกินไป —— ลดความเข้มข้นของ Mg2+ อย่างเหมาะสม: ปรับ Mg . ให้เหมาะสม2+ ความเข้มข้นโดยชุดของปฏิกิริยาตั้งแต่ 1 mM ถึง 3 mM โดยมีช่วงเวลา 0.5 mM เพื่อกำหนด Mg ที่เหมาะสมที่สุด2+ ความเข้มข้นสำหรับแต่ละแม่แบบและไพรเมอร์
A-3 พอลิเมอเรสที่ทนความร้อนได้
■ ปริมาณเอนไซม์ที่มากเกินไป —— ลดปริมาณเอนไซม์อย่างเหมาะสมในช่วงเวลา 0.5 U
A-4 อุณหภูมิการหลอม
■ อุณหภูมิการหลอมต่ำเกินไป —— เพิ่มอุณหภูมิการหลอมอย่างเหมาะสมหรือใช้วิธีการหลอมแบบสองขั้นตอน
A-5 PCR รอบ
■ รอบ PCR มากเกินไป —— ลดจำนวนรอบ PCR
เอ-1 ไพรเมอร์——ความจำเพาะไม่ดี —— ออกแบบไพรเมอร์ใหม่ เปลี่ยนตำแหน่งและความยาวของไพรเมอร์เพื่อเพิ่มความจำเพาะ หรือดำเนินการ PCR ที่ซ้อนกัน
A-2 แม่แบบ DNA
—— แม่แบบไม่บริสุทธิ์ —— ทำให้แม่แบบบริสุทธิ์หรือแยก DNA ด้วยชุดการทำให้บริสุทธิ์
A-3 มก.2+ ความเข้มข้น
——Mg2+ ความเข้มข้นสูงเกินไป —— ลด Mg . อย่างเหมาะสม2+ ความเข้มข้น: ปรับ Mg . ให้เหมาะสม2+ ความเข้มข้นโดยชุดของปฏิกิริยาตั้งแต่ 1 mM ถึง 3 mM โดยมีช่วงเวลา 0.5 mM เพื่อกำหนด Mg ที่เหมาะสมที่สุด2+ ความเข้มข้นสำหรับแต่ละแม่แบบและไพรเมอร์
A-4 dNTP
——ความเข้มข้นของ dNTP สูงเกินไป —— ลดความเข้มข้นของ dNTP อย่างเหมาะสม
A-5 อุณหภูมิการหลอม
—— อุณหภูมิการหลอมต่ำเกินไป —— เพิ่มอุณหภูมิการหลอมอย่างเหมาะสม
A-6 รอบ
—— รอบมากเกินไป —— ปรับหมายเลขรอบให้เหมาะสม

ขั้นตอนแรกคือการเลือกพอลิเมอเรสที่เหมาะสม Taq polymerase ปกติไม่สามารถพิสูจน์อักษรได้เนื่องจากขาดกิจกรรม exonuclease 3'-5' และไม่ตรงกันจะลดประสิทธิภาพการขยายของแฟรกเมนต์ลงอย่างมาก ดังนั้น Taq polymerase ปกติจึงไม่สามารถขยายชิ้นส่วนเป้าหมายที่มีขนาดใหญ่กว่า 5 kb ได้อย่างมีประสิทธิภาพ ควรเลือก Taq polymerase ที่มีการดัดแปลงพิเศษหรือโพลิเมอร์ที่มีความเที่ยงตรงสูงอื่นๆ เพื่อปรับปรุงประสิทธิภาพการขยายและตอบสนองความต้องการของการขยายชิ้นส่วนแบบยาว นอกจากนี้ การขยายชิ้นส่วนที่มีความยาวยังต้องการการปรับการออกแบบไพรเมอร์ เวลาการเปลี่ยนสภาพ เวลาในการขยาย ค่า pH ของบัฟเฟอร์ ฯลฯ โดยปกติแล้ว ไพรเมอร์ที่มี 18-24 bp จะทำให้ได้ผลผลิตดีขึ้น เพื่อป้องกันความเสียหายของแม่แบบ ควรลดเวลาในการเปลี่ยนสภาพที่ 94°C เป็น 30 วินาทีหรือน้อยกว่าต่อรอบ และเวลาในการเพิ่มอุณหภูมิเป็น 94°C ก่อนการขยายเสียงควรน้อยกว่า 1 นาที นอกจากนี้ การตั้งอุณหภูมิการขยายที่ประมาณ 68°C และการออกแบบเวลาการขยายตามอัตรา 1 kb/นาที สามารถรับประกันการขยายชิ้นส่วนที่ยาวได้อย่างมีประสิทธิภาพ
อัตราความผิดพลาดของการขยาย PCR สามารถลดลงได้โดยใช้ DNA polymerase ต่างๆ ที่มีความเที่ยงตรงสูง ในบรรดา Taq DNA polymerase ทั้งหมดที่พบจนถึงตอนนี้ เอนไซม์ Pfu มีอัตราความผิดพลาดต่ำสุดและความเที่ยงตรงสูงสุด (ดูตารางแนบ) นอกจากการเลือกเอนไซม์แล้ว นักวิจัยสามารถลดอัตราการกลายพันธุ์ของ PCR ได้อีกโดยการปรับสภาวะของปฏิกิริยาให้เหมาะสม รวมถึงการเพิ่มประสิทธิภาพองค์ประกอบบัฟเฟอร์ ความเข้มข้นของพอลิเมอเรสที่ทนความร้อนได้ และการปรับหมายเลขรอบ PCR ให้เหมาะสม
หมวดหมู่สินค้า
ทำไมถึงเลือกพวกเรา
นับตั้งแต่ก่อตั้ง โรงงานของเราได้พัฒนาผลิตภัณฑ์ระดับโลกเป็นครั้งแรกโดยยึดมั่นในหลักการ
ที่มีคุณภาพก่อน ผลิตภัณฑ์ของเราได้รับชื่อเสียงที่ดีเยี่ยมในอุตสาหกรรมและมีคุณค่าความไว้วางใจจากลูกค้าทั้งเก่าและใหม่..








